


免疫疗法的发展为癌症治疗带来了革命性的影响。而在肿瘤中特异性表达的新抗原(neoantigen),成为免疫系统区分癌细胞与正常组织、并且通过T细胞展开攻击的重要靶点。
但我们也看到,直到今天仍有相当多的癌症患者无法从免疫治疗中获益。其中,肿瘤的异质性是一个重要因素。由于不同肿瘤样本有着各自独特的突变,寻找能够对大部分患者奏效、用作通用靶点的新抗原充满了挑战性。
现在,在AI的协助下,科学家们获得了寻找免疫疗法通用靶点的强大工具!在一项发表于《科学-转化医学》(Science Translational Medicine)的最新研究中,来自辛辛那提儿童医院和弗吉尼亚大学的研究团队借助深度学习策略,开发了一套剪接新抗原发现工具(Splicing Neo Antigen Finder, SNAF),为拓展肿瘤免疫疗法的应用范围奠定重要基础。辛辛那提儿童医院Nathan Salomonis教授与李光远博士为论文共同通讯作者。

目前,免疫检查点阻断疗法等免疫疗法通常针对的是基因突变产生的新抗原,这种方法往往只对携带突变数量更多的高突变负荷肿瘤有较好的效果,这是因为这些癌细胞携带了更多的新抗原,因此更可能激活免疫系统对肿瘤的识别。而对于胶质瘤、白血病等低突变负荷肿瘤,此类疗法还难以胜任。
好在,还有一个尚未开发的免疫原性潜在靶点库,这就是源自转录后调控过程的新抗原。新抗原可由不同的转录后调控机制产生,其中RNA异常剪接会导致异常的蛋白产物,促进肿瘤转移;同时也促进了新抗原的产生,为肿瘤免疫提供潜在靶点。这些剪接相关新抗原,常常是肿瘤特异性肽的主要来源。
在最新论文中,研究团队开发的SNAF正是旨在通过识别转录后调控产生的新抗原,尤其是剪接错误来拓展免疫治疗的范围。
图片来源:123RF
“我们在项目进行中遇到了两个痛点,一个是目前没有好的衡量肿瘤靶点特异性的指标,很多临床试验药物都因为副作用而失败。另一个就是很多新抗原并不能激活体内T细胞反应,即缺少免疫原性,”李光远博士介绍道,“我们开发了两个AI工具,一个是基于贝叶斯慨率模型的BayesTS score,据我们的知识,这是目前第一次完整定义什么是肿瘤特异性,我们用到了超过3500个正常组织的RNA和蛋白质信息来训练这个模型。BayesTS可以更加准确地衡量一个靶点可能的副作用,进而在实验早期就予以规避。另一个模型DeepImmuno则是通过卷积神经网络,我们训练了8900多个实验验证数据集,DeepImmuno可以使研究者进一步聚焦到那些有免疫原性的新抗原,进而大幅度减少后期实验验证的成本。”为了从患者的RNA测序数据中全面鉴定潜在的新抗原,研究团队分别针对T细胞和B细胞治疗,创建了两个平行计算流程(SNAF-T和SNAF-B)。
基于这套“双管齐下”的策略,SNAF可以同时预测能够被T细胞识别的免疫原性MHC结合肽,以及含有B细胞可靶向胞外表位的跨膜蛋白。在随后的检验中,SNAF在基于T细胞与B细胞的疗法中均取得出了令人欣喜的发现,展现出该策略对于综合性免疫疗法的重要意义。
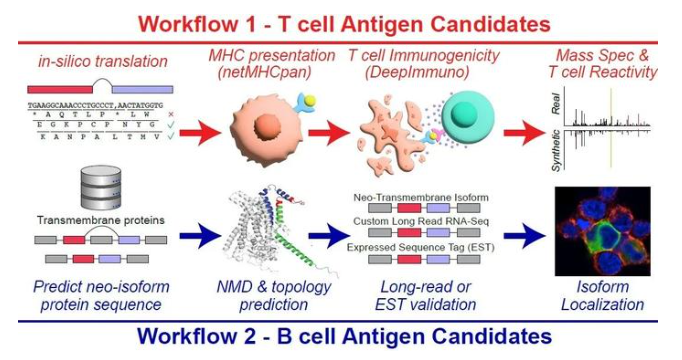 ▲SNAF能分别基于T细胞抗原和B细胞抗原寻找免疫治疗潜在靶点(图片来源:辛辛那提儿童医院)
▲SNAF能分别基于T细胞抗原和B细胞抗原寻找免疫治疗潜在靶点(图片来源:辛辛那提儿童医院)
在应用于500多名黑色素瘤患者的活检样本时,SNAF发现高达90%的患者都携带了通用的剪接相关新抗原,这一发现为治疗提供了重要的新靶点。这些剪接相关新抗原的含量与黑色素瘤患者生存期,以及对免疫疗法的应答相关。其中,SLC45A2由于高度肿瘤特异性和免疫原性,已成为一个极具前景的靶点。
除了T细胞新抗原,研究团队还基于SNAF-B发现了一类新的由于肿瘤特异性的可变剪切事件在跨膜蛋白上形成的胞外新表位,称为ExNeoEpitopes。利用最新的Alphafold2深度学习结构预测以及原位荧光实验验证,这些ExNeoEpitopes显示出开发单克隆抗体和CAR-T细胞疗法的巨大潜力。
由此,这套易于使用的、开源的全新流程能通过对剪接相关新抗原的系统鉴定,帮助发现肿瘤特异性治疗的潜在通用靶点,为更加精准的癌症治疗铺平道路。李光远博士表示,目前研究团队现在正在进一步研究如何将该策略运用到其他的靶点发现上,并且已经看到了一些非常有意思的发现。同时,团队的目标也是将可变剪切的靶点进一步推向临床前,真正开发出新的癌症治疗策略。