


近年来,越来越多的研究证据显示,微生物群与癌症密切相关,甚至在癌症的发展和转移中发挥着关键作用。2020年5月,以色列魏茨曼科学研究所 Ravid Straussman 团队在 Science 发表论文,他们发现,大部分实体瘤中含有细菌,这些细菌大多是存在于癌细胞内的“胞内菌”。而且,这些细菌可能具有肿瘤特异性,不同类型肿瘤中具有不同种类的细菌。2022年4月,西湖大学蔡尚团队在 Cell 期刊发表论文,他们首次证实了乳腺癌组织中存在的多种独特 “胞内菌”在肿瘤转移定植过程中所起的关键作用,这一发现也是对传统肿瘤转移理论的重大突破。2022年9月,以色列魏茨曼科学研究所 Ravid Straussman 团队和加州大学圣地亚哥分校 Ravid Straussman团队分别在 Cell 期刊发表论文,发现除了细菌以外,另一类微生物——真菌,也在不同肿瘤中普遍存在,它们与肿瘤转移、癌症患者生存率降低密切相关。
2023年9月19日,上海交通大学医学院王慧、同济大学张鹏以及中科院巴斯德所陈昌斌课题组共同通讯在Cancer Cell(IF=50.3)上发表了题为“The intratumor mycobiome promotes lung cancer progression via myeloid-derived suppressor cells”的研究性论文。该研究通过真菌富集DNA提取和深度shotgun宏基因组测序,在肺腺癌(LUAD)患者中发现了聚多曲霉(Aspergillus sydowii)。通过3种不同的同基因肺癌小鼠模型,作者发现A. sydowii通过IL-1 介导的MDSCs的扩增和激活促进了肺肿瘤的进展,从而抑制了细胞毒性T淋巴细胞的活性和PD-1+CD8+T细胞的积累。对人体样本的分析进一步证实,丰富的A. sydowii与免疫抑制和患者预后不良有关。作者的研究结果表明,尽管肿瘤内真菌群落的生物量很低,但它促进了肺癌的进展,并且可以针对菌株来改善LUAD患者的预后。
主要内容
一、肿瘤内菌群失调与LUAD病理学相关,并富含一种活真菌
接下来,研究人员探索了真菌群和LUAD病理之间的潜在联系。虽然担子菌门/子囊菌门在非肿瘤组织与鳞状和腺状占主导地位的肿瘤组织中的比率相似,但他们发现,在侵袭性更强的实体、微乳头和乳头占主导地位的亚型中,差异更大,这表明真菌菌群失调与LUAD侵袭性之间存在潜在的相关性(图1E)。此外,研究发现曲霉位于肿瘤组织与非肿瘤组织的两个反相关簇的中心(图1F),表明了肿瘤组织中曲霉相关分类簇的独特特征。序列分析也发现肿瘤组织中意外富集了聚多曲霉(A. sydowii)(图1G)。
进行培养组学和PacBio全基因组测序,以验证真菌DNA序列是否为活菌。从7名另外选择的LUAD患者的新鲜肿瘤组织中分离出3株活真菌(表S3),并确认为A.sydowii(图1H和S3A;表S4)。分析了宏基因组功能的改变,研究者发现肿瘤内真菌组中溶酶体、核糖体和RNA降解途径等几种信号通路显著增加(图1I和S4B;表S6)。综上所述,结果有力地揭示了LUAD患者真菌生物群景观和功能特征的改变,并确定了富集的肿瘤定植活A. sydowii的存在。
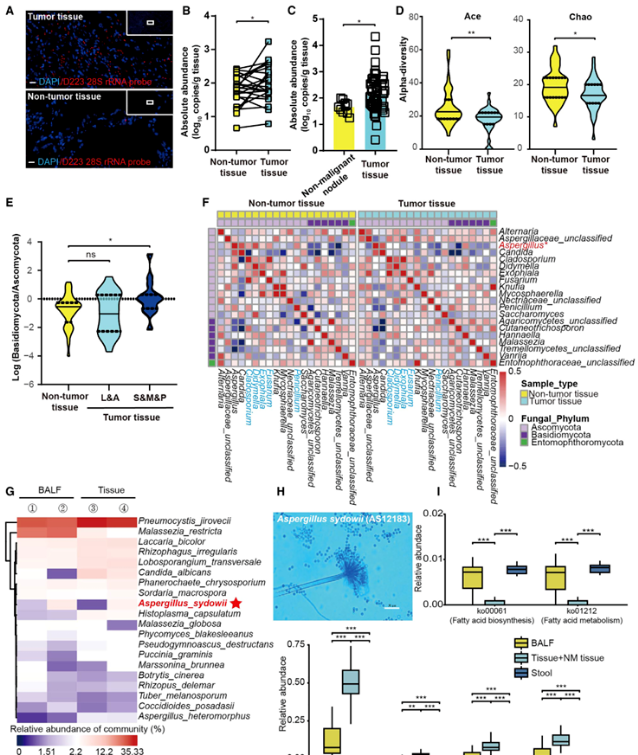
图1.肿瘤内菌群失调与LUAD病理相关,并鉴定出高度丰富的活菌
二、定植在肿瘤中的A. sydowii通过诱导具有免疫抑制作用的TME来促进肺肿瘤的进展
为了确定A. sydowii(AS12183)是否对肺部肿瘤的进展具有功能性影响,使用已建立的路易斯肺癌(LLC)小鼠模型,在瘤内注射A. sydowii AS12183(图S5A)。研究人员发现,与烟曲霉菌和白色念珠菌相比,多聚曲霉加速了LUAD的进展,表现为肿瘤体积和肿瘤重量的增加(图2A–2C and S5B)。通过FISH验证了瘤内A. sydowii 的持续存在(图S5C)。同样,用A. sydowii处理后,LLC细胞增殖明显增加(图2D)。这些数据表明,A. sydowii 在肺癌进展过程中具有功能性作用。
研究表明,微生物群通过与宿主免疫系统的相互作用影响致癌作用。为了检测真菌A. sydowii对TME的潜在影响,使用小鼠LLC模型的肿瘤样本对A. sydowii特异性转录谱进行了体内RNA-seq分析(图2E)。上调基因在髓系白细胞趋化和迁移、ROS代谢过程和IL-1β生成方面有明显的富集(p < 0.05)(图2F)。值得注意的是,与MDSCs和M2巨噬细胞相关的调控基因的表达在A.sydowii组显著增加,这与免疫系统负调控因子的表达增强一致。这些数据表明,A.sydowii可以通过诱导免疫抑制基因信号来促进肺肿瘤的进展。
研究人员进一步使用流式细胞术来确定有或没有Sydowii感染的浸润性肿瘤中各种免疫细胞类型的相对变化。同样,A. sydowii处理导致MDSCs (CD11b+Gr1+)的比例急剧增加,特别是PMN-MDSCs (CD11b+Ly6G+Ly6Clow)在肿瘤组织中的富集。然而,研究人员没有观察到M2巨噬细胞和Th17细胞群的可量化差异(图2G, 2H和S5D-S5F)。有趣的是,研究人员还注意到暴露于A. sydowii的小鼠TME中Tregs的比例更高(图2I和2J)。在感染A. sydowii并使用两性霉素B (AmB)治疗的小鼠中,进一步评估了A . sydowii对肺肿瘤进展的可能贡献。显然,AmB的真菌耗竭阻断了肿瘤的进展(图2K)。因此,研究人员的数据表明,A. sydowii通过MDSCs和Tregs的局部扩张促进肺肿瘤进展,这两种细胞都是免疫抑制TME的关键成分。
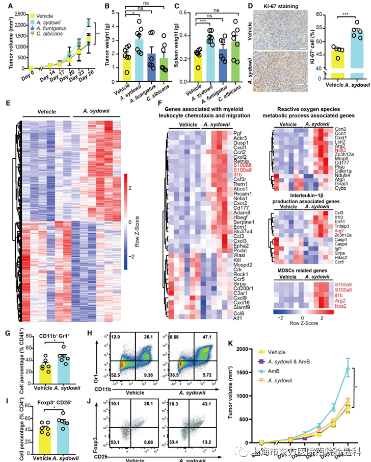
图2.肿瘤定植A. sydowii通过诱导免疫抑制TME促进肺肿瘤进展
三、A.sydowii在肺部的局部定植促进肿瘤进展
为了进一步证实前面的发现,研究人员建立了原位LUAD小鼠模型,该模型更接近LUAD的微环境。通过气管内接种从自发性KP-LUAD小鼠体内获得并体外扩增的KrasLSL-G12D/+/P53fl/fl(KP)细胞,发现A.sydowii持续且显著地促进了肿瘤的进展(图3A)。IL-1β,是一种与MDSCs的趋化和扩张有关的肿瘤相关因子,在肿瘤中上调(图3B)。在TME中,MDSCs和Tregs的扩增显著增加,特别是PMN-MDSCs的富集,而不是Th17的富集(图3C-3E和S5H)。研究表明,MDSCs最初在骨髓中产生,并迁移到肿瘤中,促进TME的形成。CD8+程序性细胞死亡蛋白1 (PD-1)+T细胞也在原位LUAD小鼠模型中积累(图3F)。PD-1在肿瘤浸润性抗原特异性T细胞上的表达限制了其抗肿瘤活性。
为了确定真菌生态失调对肺肿瘤进展的影响,研究人员在原位LUAD小鼠模型中通过口服AmB清除真菌组。正如预测的那样,菌群耗竭使暴露于A. sydowii的小鼠免于肿瘤的加速生长(图3G)。考虑到所采用的给药途径(口服)可能导致小鼠肠道和肺内真菌种群的系统清除,研究人员还开发了一种更有针对性的方法,即雾化吸入Amb。研究人员同样发现,AMB治疗有效地降低了肿瘤负担(图3H)。最后,在腺病毒转导Cre重组酶诱导的自发性KP LUAD小鼠模型中,研究了A.sydowii在LUAD进展中的确切作用,以探索A.sydowii在LUAD定植中的作用。研究人员发现A. sydowii显著促进肺肿瘤进展,加速肿瘤细胞增殖(图3I和3J)。与之前的观察结果一致的是,研究人员还发现肿瘤组织中IL-1β的表达上调,并且在A. sydowii处理后,TME中MDSCs、Treg和PD-1+CD8+的比例增加(图3K-3O、S5N和S5O)。这些结果表明,瘤内A. sydowii通过大量招募和扩增MDSCs以及Tregs和PD-1+CD8+T细胞的浸润,诱导免疫抑制性局部微环境,从而导致LUAD进展加速。

图3.A. sydowii在肺部的局部定植促进肿瘤进展
四、A.sydowi诱导的免疫抑制是由TME中MDSCs活性增强介导的
研究人员评估了A.sydowii诱导的MDSCs的耐受活性。A.Sydowii处理显著增加了Arg1和NOS2的表达。在原位和自发的小鼠LUAD模型中,A.sydowii提高了从小鼠LUAD组织分离的MDSCs的精氨酸酶活性和NO和ROS的产生(图4A-4E和S6A-S6C)。在功能上,与未接触A. sydowii的小鼠相比,暴露A. sydowii小鼠中分离的肿瘤来源的MDSCs存在时,体外T细胞诱导的LUAD细胞杀伤功能明显受损(图4F和S6D),这表明A. sydowii促进了MDSCs的功能成熟和活性。
据报道,MDSCs可以诱导Treg的扩增,研究人员将原代CD4+T细胞与从A.sydowii处理的肿瘤组织中分离的MDSCs孵育。发现与载体MDSCs相比,分化的Treg细胞比例更高(图4G、S6E和S6G)。此外,研究人员推测TME中PD-1+CD8+T细胞的浸润可能是由于A.sydowii诱导的MDSCs表达PD-L1所致。事实上,研究人员发现原代CD8+T细胞上PD-1的表达在与来自A.sydowii暴露的小鼠的肿瘤驻留MDSCs孵育后显著增加(图4H、S6F和S6H)。
为了进一步证实MDSCs在LUAD TME中的作用,研究人员使用Gr1单抗进行了体内MDSCs耗竭实验(图4I)。通过抗Grl处理的MDSC的耗竭显著降低了聚多曲霉处理的原位LUAD鼠模型中的肿瘤生长(图4J),并显著降低了MDSC的丰度,但对PMN-MDSC与M-MDSC的比率没有影响(图4K、4L、S6 I和S6 J)。与同型对照相比,Tregs和PD-1+CD 8 +T细胞的数量也减少(图4 M、4 N、S6 K和S6 L)总之,这些结果最终证明,A. sydowi 诱导的免疫抑制对肿瘤的促进作用是通过增加TME中MDSCs的活性来介导的。
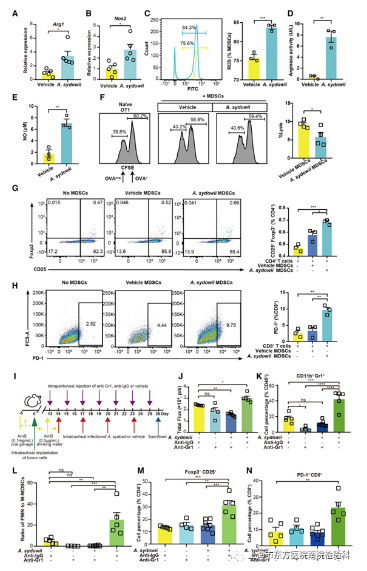
图4.A. sydowii诱导的免疫抑制是由TME中MDSC活性增加介导的
五、A.sydowii通过β-葡聚糖介导的Dectin-1/CARD9信号通路促进MDSC的成熟和活性
先天性免疫反应是抵御病原体入侵的第一道防线。鉴于巨噬细胞在真菌病原体的保护性免疫中的作用,研究人员发现体内巨噬细胞的丰度从15%增至近25%(图5A)。真菌病原体可以通过模式识别β-葡聚糖受体Dectin-1及其下游接头蛋白CARD9诱导中性粒细胞MDSCs。研究人员发现,骨髓衍生巨噬细胞(BMDMs)和A. sydowii的共培养上清液促进了它们向MDSCs的分化,并增强了CARD9的表达,这与研究人员的体内研究结果一致(图S7A-S7C、5B和5C)。
研究人员进一步确定了Card9的缺失是否会影响A. sydowi通过MDSCs介导的LUAD加速。值得注意的是,与WT小鼠相比,Card9-/-小鼠在LUAD模型中由A. sydowii诱导的肿瘤进展加速明显减弱(图5D)。与WT相比,Card9-/-小鼠源性肿瘤显示MDSCs分化减少(图5E)。与此一致的是,研究人员观察到TME中浸润的Tregs和PD-1+CD8+T细胞比例较小(图5F和5G)。至于MDSCs的功能,Card9-/-小鼠的ROS、精氨酸酶和NO的产生显著降低(图5H-5J)。这些活性较低的MDSCs允许更多的细胞毒性T淋巴细胞介导的肿瘤细胞杀伤,导致肿瘤进展减慢(图5K)。总之,这些数据表明,A. sydowii通过β-葡聚糖介导的Dectin-1/CARD9信号通路诱导MDSCs分化和活性。
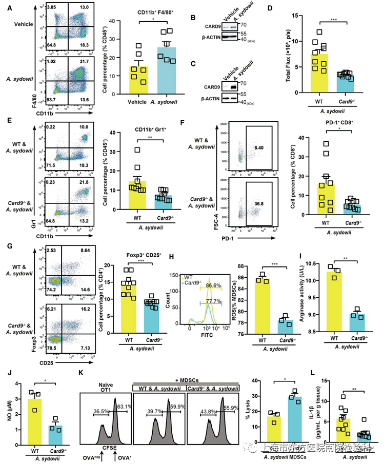
图5.A. sydowii通过β-葡聚糖介导的Dectin-1/CARD9信号通路促进MDSC的成熟和活性
六、IL-1β阻断逆转A.sydowii诱导的免疫抑制
暴露于A. sydowii 或β-葡聚糖的WT BMDM 显示IL-1β的分泌显着增加,而且,在源自Card9-/-小鼠的肿瘤中观察到IL-1β分泌减少(图5L)。因此,研究人员推测,IL1b代表了β-葡聚糖介导的Dectin-1/CARD9信号通路的下游效应物。
研究人员用Ultra-LEAF纯化的抗IL-1βmAb中和了BMDMs和A. sydowii或β-葡聚糖共培养物中分泌的IL-1β。为了进一步验证IL-1β在LUAD TME 中的作用,研究人员使用IL-1βmAb 进行了体内IL-1β中和实验(图6A)。IL-1βmAb治疗显著降低了A. sydowii处理的原位LUAD小鼠模型的肿瘤生长(图6B),并显著降低了MDSCs的丰度和PMN-MDSC与M-MDSC的比例(图6C和6D)。与同型对照相比,Tregs和PD-1+CD8+T细胞的数量也减少了(图6E和6F)。同样,研究人员观察到A. sydowii和IL-1βmAb处理小鼠的MDSCs中ROS、精氨酸酶和NO的产生减少,导致其肿瘤杀伤活性消失(图6G-6J)。
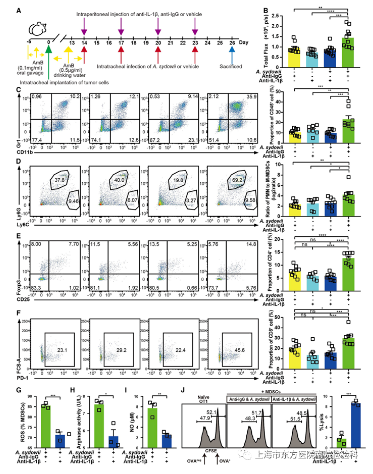
图6.阻断IL-1β可逆转A.sydowii诱导的免疫抑制
七、患者样本中高丰度的A. sydowii与免疫抑制和不良临床结果相关
为了评估LUAD患者肿瘤内A . sydowii与肿瘤免疫抑制环境之间的关系,研究人员对92例LUAD患者的肿瘤组织进行了FISH和免疫荧光染色,以探索MDSCs、Tregs和PD-1+CD8+T细胞在TME中的分布(图7A-7D;表S7)。研究人员发现A. sydowii的高丰度与肿瘤浸润的MDSCs、Tregs和PD-1+CD8+T细胞的增加呈正相关(图7E-7G)。这些在LUAD患者中的结果与研究人员在小鼠LUAD模型中的发现一致。
为了更深入地了解A . sydowii与患者预后的关系,研究人员进行了进一步的相关分析,发现A. sydowii的富集与患者的侵袭性病理和淋巴结侵袭有关(图7H)。考虑到在不同阶段(80% at IA to 30% at IIIA)的生存的显著差异,研究人员分析了A. sydowii在I、II、III和IV阶段的丰度。有趣的是,研究人员观察到A. sydowii的丰度随着阶段的增加而增加,这与提出的机制一致(图7I)。在分析A. sydowii的预后价值时,对患者的总生存期(OS)和无进展生存期(PFS)进行了分层(图7J和7K)。总之,研究人员的数据不仅有助于支持真菌组在癌症进展中的作用,而且还表明A . sydowii作为预测疾病结局的有前途的生物标志物的临床应用。

图7.A.sydowii的高丰度与免疫抑制和患者预后不良有关
本研究的亮点为:
1.在肺腺癌(LUAD)患者中发现了丰富的肿瘤内聚多曲霉(A. sydowii)
2.A. sydowii在三种同基因小鼠肺癌模型中促进LUAD
3.A. sydowii通过β-葡聚糖/ Dectin-1/CARD9途径分泌IL-1b诱导MDSCs
4.大量的A. sydowii与免疫抑制和患者预后不良有关